電池の原理は分かったかしら? ここでは具体的にどんな電池を人類が発明してきたかを見ていくわよ。
まず最初、電池の構造を持つ最古のものとされるのがバグダッド電池。なんと紀元前200年台。ただしこれは電池としては使ってなかったみたいで(メッキ説がある)、当時の人たちは電気に関心を寄せなかったみたい。お酢とかワインが電解液だったらしいわよ。
そこから2000年もの間、人類は電気という存在に気付かず過ごしたわ。何やってたんだろうね。
時は流れて18世紀の終わり、産業革命の真っ只中にあったヨーロッパで、ガルヴァーニさんがついに電気の歴史を巻き起こす。
彼は動物の解剖学者だったんだけど、カエルの解剖に勤しむある日、カエルの足が2本のメスとの接触で痙攣することに気付いた。(多分、材料の違うメスをいくつか持ってたんだと思う)
カエルの体液も電解液として使えるんだけど、彼は「体液+2種の金属」ではなく、カエルの体そのものによる発電だと考えた。
これに異を唱えたのがボルタで、名前でもう分かると思うけどボルタが電池を発明することによって決着が着いたわ。当然この電池にカエルの体液は使ってなくて、こうなってるわよ。
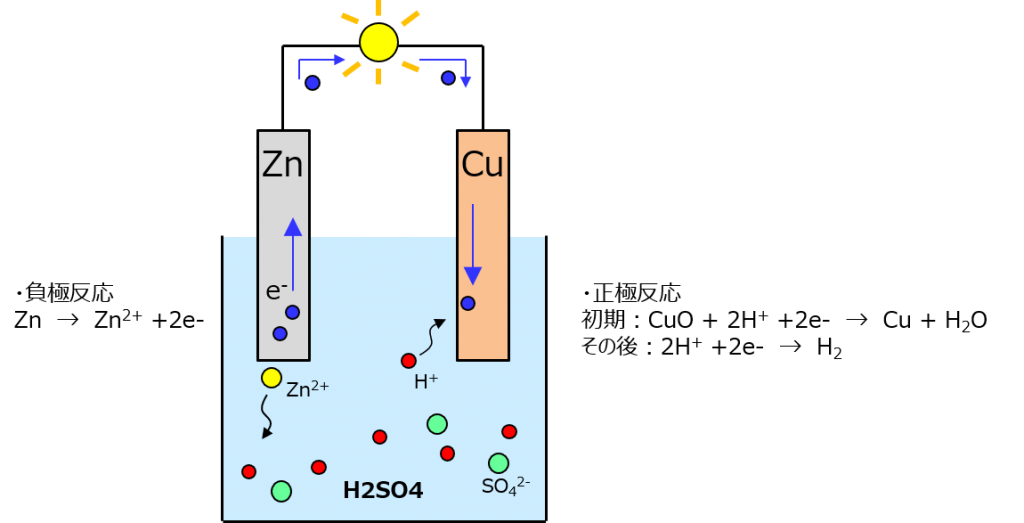
これがかの有名なボルタ電池よ。亜鉛の標準電極電位はマイナス0.763Vで銅はプラス0.342Vだから、イオン化傾向の高い亜鉛の方が電子を奪われることになるわよ。
電解液の外で銅と亜鉛を繋いでたら、亜鉛が手放した電子は銅の方に移動していくわ。ここに電球とかがあればピッカーンって点くってワケ。
ボルタ電池の化学反応は2段階あって、最初のうちは銅の表面に自然酸化膜(10円玉が綺麗な銅じゃなくて茶色になってるのはこれ)があるからまずはそれが還元されるわよ。還元が終わってCuOがなくなったら、あとは硫酸中の水素イオンが電子を受け取って水素になる反応だけになる。
式を見ての通り、銅が反応に加わるのは最初のうちだけだから、それが終わると電池の起電力は落ちるわよ。最初のうちは0.342 – (–0.763) = 1.105 V の電圧が出るけど、正極反応が水素だけに変わってからは、水素の標準電極電位はゼロだから起電力は0.763 Vになるわ。
それから、ボルタ電池はもうひとつ欠点を抱えてて、H+ + 2e- → H2 の反応で出た水素が銅にへばりついて、銅が水素に覆われて硫酸に触れられなくなって反応が止まってしまうの。これを分極と呼んでいて、こうなったら電圧は出なくなるわよ。
※「分極」という言葉は何通りか意味があるから注意!
この分極の問題を解決したのがダニエルさんよ。電解液が入ってる容器を壁で2つに仕切って、片方を硫酸亜鉛(亜鉛を溶かした硫酸)、もう片方を硫酸銅したの。ただし、この2つを仕切る壁は、イオンなら通すことができる。
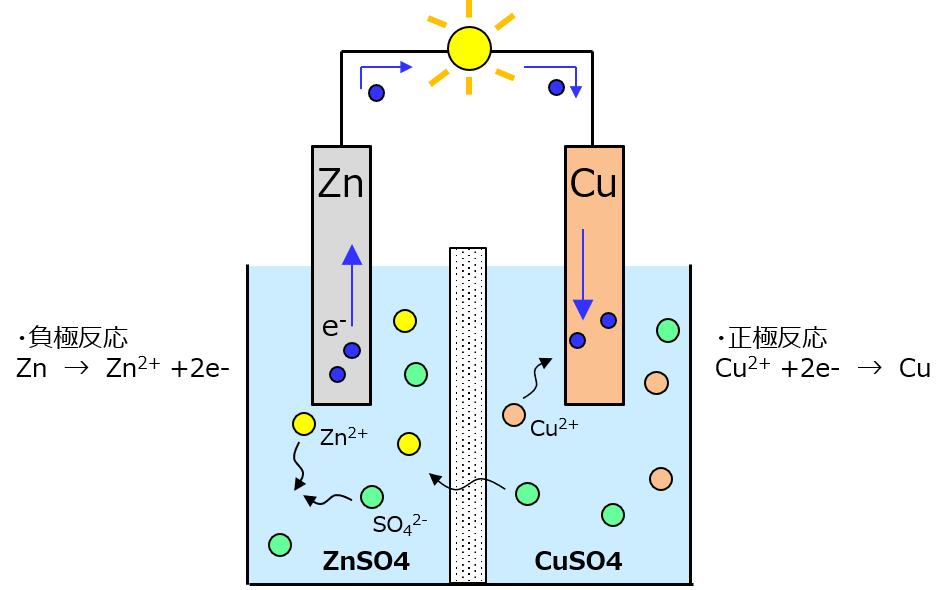
どうなってんじゃいって話なんだけど、イオンは原子レベルで小さいものだから、ナノレベルの小さい穴の開いたものを使えば、イオンは通すけど水は通さないっていう壁ができるわよ。この壁の呼び方は色々あるんだけど、私はセパレータって呼んでる。
ナノレベルの小さい穴の開いたものは多孔質って呼ばれるんだけど、当時なら素焼きの粘土とかよ。現代だと工業的にセラミック板を作ることが多いわね。
セパレータはイオンを通すから、正極と負極の容器を完全に2つに分けてセパレータ材で電解液同士を橋渡ししても良いわよ。その橋は塩橋(えんきょう)って呼ばれてるみたいね。
反応式を見ての通り、亜鉛はちょっとずつ溶けていって銅はちょっとずつ銅板に付いていくわよ(析出ってやつね)。反応は亜鉛がなくなるか硫酸亜鉛が飽和するか、硫酸銅の中の銅イオンがなくなったら止まるわ。
さてこれで電池としてはほぼ完成形なんだけど、ダニエル電池にも大きな問題点があった。そう、液体だから持ち運びに困ること。しかも硫酸だから危ない。そこでルクランシェさんという人が持ち運べるような電池を発明したのよ。
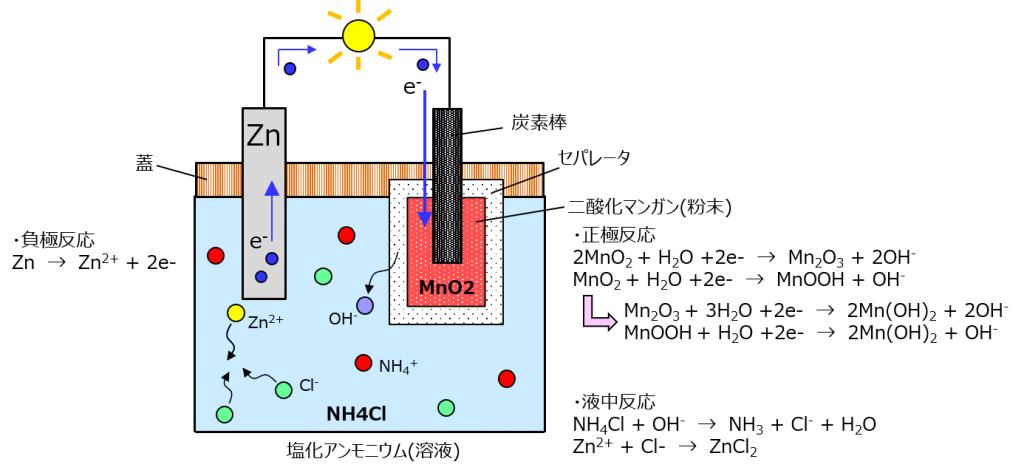
結局液体を使ってるんだけど、蓋してガラス瓶に閉じ込めて使ってたのよ。実際これのおかげで電報とか電話が急速に普及した。そして、今も使われてるマンガン電池の基にもなったのよ。起電力はだいたい1.4V。普通に電池として使える数字になったわね。
電池の構成要素が増えてきたけど、炭素棒は電子を取り込むための存在で、反応には関わらないわ。
電子を受け取った二酸化マンガンは、水と反応して酸化マンガン(Mn2O3)とオキシ水酸化マンガン(MnOOH)になって、それで発生する水酸化物イオン(OH-)が塩化アンモニウムと反応してアンモニアと水、塩化物イオン(Cl-)ができるわよ。塩化物イオンは液中に溶け込んできた亜鉛イオンとくっついて塩化亜鉛(ZnCl2)になるわ。
反応が進んでいくと、酸化マンガンとオキシ水酸化マンガンも水と反応して水酸化マンガン(Mn(OH)2)ができていくわよ。これらは水溶液には溶けずに沈殿するわ。
ちなみに、ルクランシェ電池もダニエル電池同じく水素は出ないわよ。水素イオンがマンガンとくっついてオキシ水酸化マンガンになるから。こういった、分極が起こるのを防ぐ材料のことを減極材と言うわよ。
ルクランシェ電池もそれなりには愛されたんだけど、やっぱりガラス瓶ってのは不便だった。あと、反応が進むと内部抵抗が大きくなって電圧が落ちてくるっていう問題もあった。んで、人類が辿り着いたのがマンガン乾電池よ。
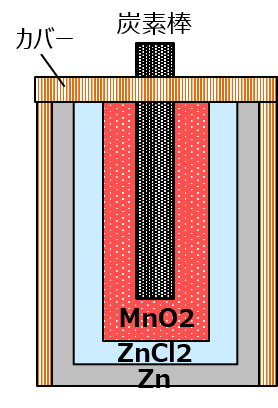
おなじみの形になったわね。実際の製品はもうちょっと複雑なんだけど基本的にはこうよ。電解液に塩化亜鉛を使ってる以外はルクランシェ電池と同じだけど、その電解液がペースト状になってるの。果たしてそれは「乾」なのか? ってトコだけど。実際、液漏れるしね。
乾電池も100年以上かけて改良に改良が進んでて、今のマンガン電池は、二酸化マンガンの粉に電解液を混ぜ合わせた合剤を正極の位置に詰めてるわよ。それでセパレータは紙。

次、みんな大好きアルカリ電池。正確には「アルカリマンガン電池」よ。どっちなんじゃいって話だけど、どっちも使ってるからこんな名前なの。
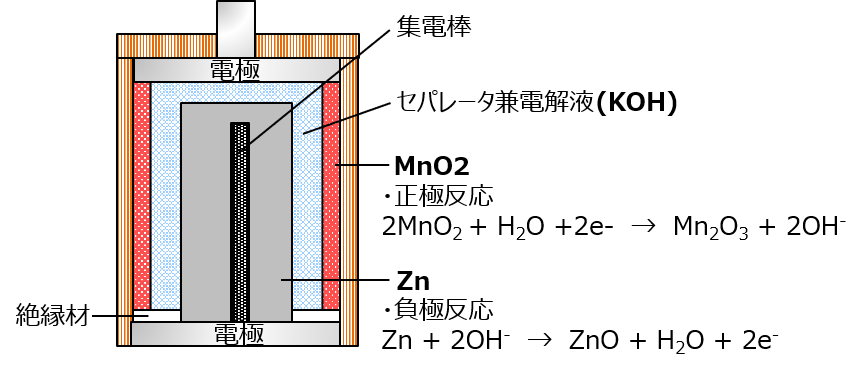
注意したいのが、正極と負極の位置がマンガン電池と逆になってること。最終的に突起をプラスにするのは一緒だけど、内部の配置は逆になってるわ。
見ての通りマンガンは使ってるのと、「アルカリ」のネーミングは電解液のKOH(水酸化カリウム)から来てるわ。Kはカリウムで、周期律表の一番左、つまりアルカリ金属だからよ。
アルカリ電池では、電解液はセパレータに染み込ませるわ。あと負極の亜鉛にもゲル状の電解液を混ぜ込んでる。液漏れで出てくるのはこれね。ちなみにこの水酸化カリウム、かなり強いアルカリ性だから触らない方がいいわよ。
さてこの、100年以上前に発明されたマンガン電池と50年以上前のアルカリ電池が共に、改良は進んでいるものの今でも大活躍しているわ。
実は一時期、オキシライド(パナソニック商標)っていうニッケルを使ったのもあったんだけど、そのパナソニックもアルカリに戻してる。
こうやって電池はほぼ完成形に辿り着いたんだけど、人類というのは欲張りなもので、もっと使い勝手の良いものが欲しくなった。そう、充電式電池よ。二次電池って呼ばれ方をすることが多いわね。これまで紹介してきた、充電できないタイプのものは「一次電池」って呼ばれるわ。
さっきニッケルの単語が出たからそれからいくけど、二次電池としてのニッケル電池は今でも現役よ。ニッカドとニッスイね。(ちなみにオキシライドは、ニッケル一次電池に分類される)
ニッカドはカドミウム、ニッスイは金属の水素化物を負極に使ったもので、カドミウムが毒だからニッスイの方が多いけど、一応はどっちも出回ってる。正極はオキシ水酸化ニッケル、電解液は水酸化カリウム水溶液よ。化学式とかが気になる人は調べてみてね。
で、今みんなが毎日のように充電してる電池はニッケル系じゃないわ。リチウムイオン電池よ。スマホもパソコンも、カメラとかもみんなこれ。これを発明したメンバーがノーベル賞を受賞して、うち1人が日本人だったから話題になったわね。
「スマホに入ってる電池の何が凄いんだ?」とか思っちゃダメよ? 誰もが当たり前のように使うものこそが、究極の発明なんだから。
世のため、人のため、あるいは自分のため。夢、希望、ロマン。色んな想いを抱きながら、それが本当に形になるのか、なったとして歓迎されるのか分からないままに、「そんなの実用化できるはずがない!」とか言われながらも、科学者たちが追い求めた結晶が、私たちの生活を支えているの。
人類の素晴らしさに想いを馳せるのはこれくらいにして、リチウムイオン電池いくわよ。リチウムイオン電池はマンガンやアルカリとは違って「材料はこれ!」っていうのは特に決まってなくて各社バラバラよ。リチウム系を使うことだけは共通だけど。 とりあえずポピュラーなものってことで、正極はコバルト酸リチウム(LiCoO2)、負極は黒鉛(C)で説明するわ。
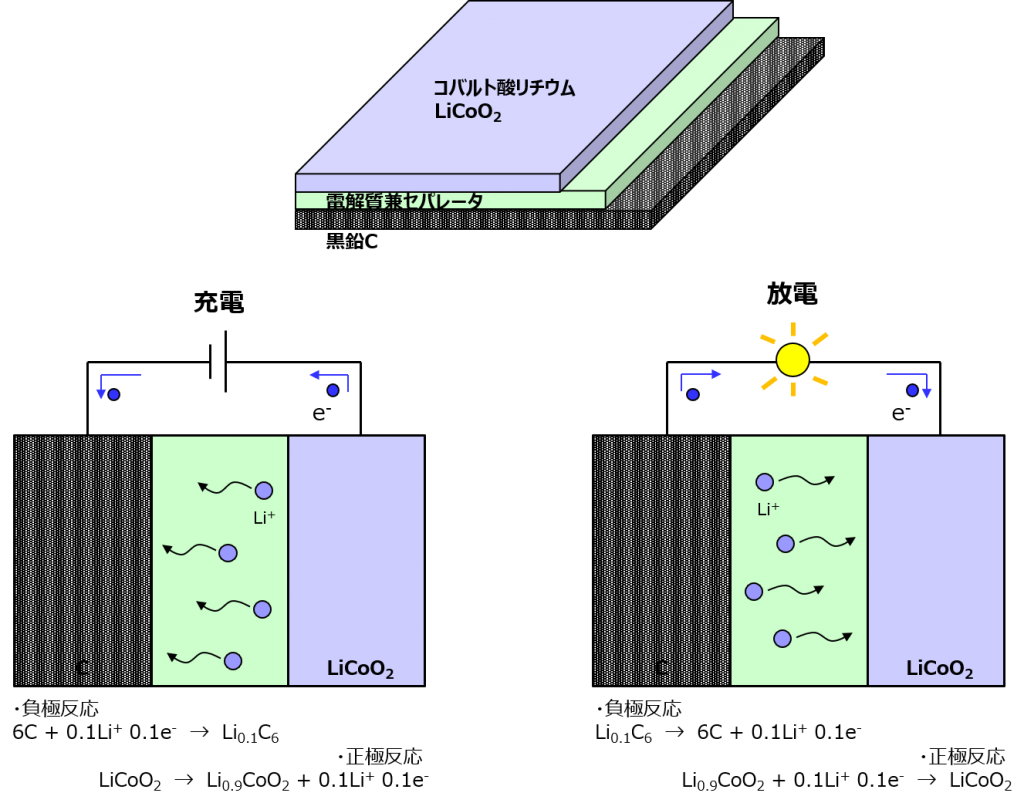
リチウムイオン電池はホンマモンの「乾」電池で、電解液じゃなくて電解質を使うわ。炭酸エチレン(常温で固体)とかの有機溶媒とリチウム塩(リチウムと非金属がイオン結合したもの)を混ぜたものよ。もちろんリチウムイオン(Li+)の伝導性を持ってる。
構造は色々あるんだけど、ペラペラの薄いやつを重ねてぐるぐる巻きにしたものが多いわね。面積を稼げるからそうしてるのよ。
図を見ての通り、リチウムイオンが電解質の中を漂って反対側に移動するわよ。充電の時は、コバルト酸リチウムが電源に電子を奪われて、一部のリチウムがイオン化して、電界に引っ張られて炭素を目指す。
充電をやめて負荷を繋ぐと、最外殻軌道に電子が1個しかないリチウムは早々に電子を手放して、充電で中途半端にリチウム成分が減ったコバルト酸リチウムのもとへと帰って行くわ。0.1とか0.9とかは私が勝手に入れた数字よ。「x」とか「1-x」で表現されることが多いけど、イメージしにくいでしょ。
リチウムイオン電池の起電力は、なんと3.7 V。電圧が高いと電力も稼ぎやすくって、小さな体で大きな容量を持つことができるから、これが主流になったのよ。
だけどちょっとした弱点もあって、過充電と過放電に弱い。コバルト酸リチウムが分解されて酸化コバルトとか酸化リチウムができて、電池特性が劣化するわ。20~80%ぐらいの範囲で使えって言われるのはこのためよ。けどたまに100%充電と完全放電をさせてリフレッシュさせるといいわよ。
もうひとつ、よく使われてる二次電池があるわね。そう、鉛蓄電池よ。車のバッテリーがこれね。歴史としてはリチウムイオンよりもこっちの方が断然古くて、100年は差があるわ。
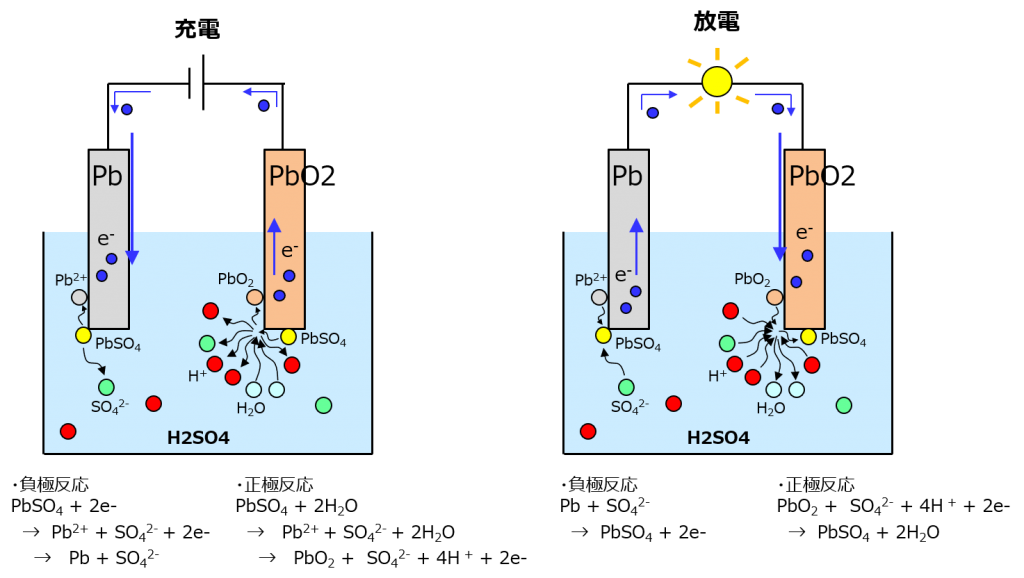
電極は鉛と二酸化鉛、電解液は希硫酸よ。充電の時は硫酸鉛(PbSO4)が分解されて、負極では鉛、正極では二酸化鉛ができていく。電極に直接付いていくわよ。
放電の時は鉛がイオン化して液中の硫酸イオンとくっついて硫酸鉛になる。鉛とか二酸化鉛が削れて硫酸鉛が付いていく感じね。
図とか式を見ての通り、充電の時はH2Oが消費されてSO42-が生成されるから硫酸が濃くなる。反対に放電の時は硫酸が薄くなるわよ。
これ1つで2 Vの起電力が出るから、これを6個直列にして車のバッテリーは12 Vになってるわよ。
とりあえず基本的な電池は網羅できたかしら? けどまだちょっと、電池というネーミングになってるものがあるから紹介するわね。燃料電池と太陽電池よ。この2つは結構な電力が取れるから、イメージとしては発電機に近いわね。
まずは燃料電池から。原理としては普通の電池と大して変わらないわ。ただし、これまでは金属とその酸化物がメインだったことに対して、これは気体の水素と酸素を使う。イオン化さえできれば気体だって電池になるのよ。
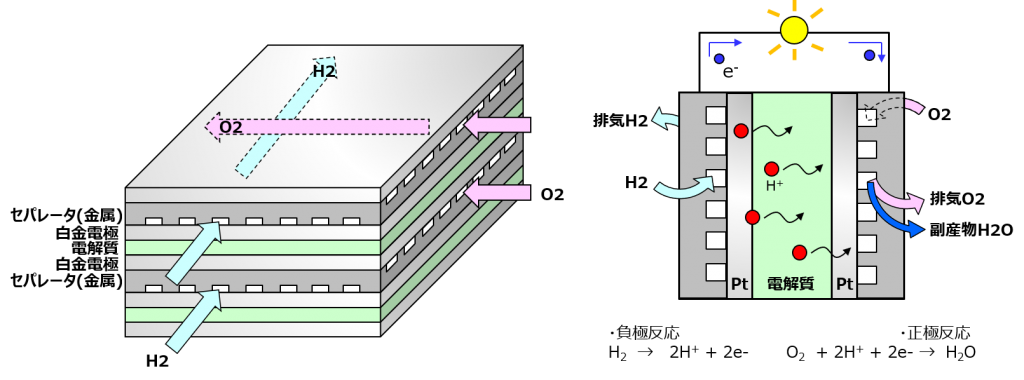
燃料電池にはいくつか種類があるんだけど、これは固体高分子形よ。名の通り、電解質に高分子材料(ポリマー)を使ってる。
構造としては、薄い板みたいなのをたくさん並べたものになってるわ。電極・電解質・電極のセットで電池1個分で、電極のそばを水素や酸素が通ることで発電されるわよ。
燃料電池で言う「セパレータ」は水素と酸素を分けるためのもので、それらの通り道になる溝が掘ってあるわ。酸素の標準電極電位が1.2ボルトで、これが電池1個分の出力だから直列に何個も繋げるのよ。
電解質と水素の間に白金があるけど、これは多孔質にすれば水素イオンはそこを通って行けるわ。
そもそも白金は必要なのか? って話だけど、これが、必要。触媒と言って、反応には参加しないけどその場にいることによって反応を促進させる作用を持ってるの。
電解質は水素イオンの伝導性さえあればいいんだけど、最近はフッ素系ポリマーが多いわね。各社が開発に勤しんでるわ。
燃料は水素なんだけど、これが実は自然には存在しないから、メタノールとか、家庭用エネファームだと都市ガスを分解してやってる。メタンガスとか二酸化炭素が出ちゃうんだけど、火力発電に頼るよりはマシだから注目されている技術よ。
次、太陽電池。ソーラーパネルのやつね。これも「電池」っていうネーミングになってるんだけど、原理がまるっきり違ってて、半導体の力を使ったものよ。
半導体の話がまだなんだけど・・・シリコンは半導体で、それにアルミとかリンとか周期律表で隣にいるやつ(つまり最外殻電子の数が1個違うやつ)を混ぜると、アルミならp形半導体、リンならn形半導体になるわよ。
半導体はマイナス電荷を持つ電子とプラス電荷を持つホールの両方があって、p形はホールが、n形は電子の方が多くなってるの。
この2つをくっつけたものをpn接合と呼んでいて、ダイオードがその構造よ。実は太陽電池も同じ構造で、光を当てることで電子を外に取り出せるの。
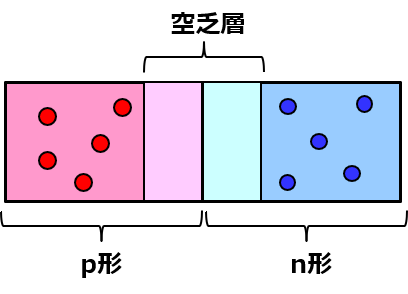
まず、pn接合を作ると、それぞれの中にいる電子とホールは、磁石のNとSがくっつくのと同じように引き寄せ合って、ぶつかって、消滅する。ホールは電子の抜け殻だから、そこに電子が来ると埋まって中性になるの。これを再結合と言うわよ。
すると、pn接合付近にはキャリアが存在しない領域ができてしまう。これを空乏層(くうぼうそう)と呼ぶわよ。
p形とかn形とかは、ホールと電子のどっちが多いかに過ぎなくて、金属内に電子がウヨウヨいるのと同じように結晶内で漂ってるだけだから、p形半導体もn形半導体も電気的には中性よ。
ところが、再結合してしまうと、そうはいかなくなる。p形はホールが、n形は電子が多めにいることで中性だったのだから、それらがいなくなることによって電荷を帯びることになる。だから、空乏層は内部にイオン(つまり荷電粒子)が存在することになるわよ。
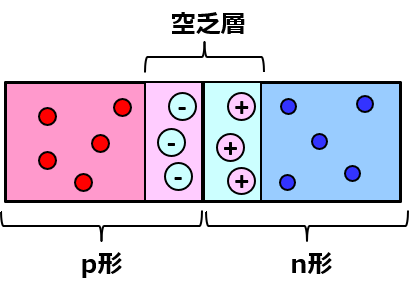
ややこしいことに、p形の空乏層はマイナス、n形の空乏層はプラスの電荷を帯びることになるわ。これは、p形だとアルミニウムイオン(Al–)、n形だとリンイオン(P+)で、母体であるシリコンと結びついてるからその場を動けない。
※普通アルミがイオン化する時は電子を失ってAl3+になるけど、シリコン結晶中だとシリコンから電子を受け取るからAl–になるわよ。半導体ならではのことだから注意!
更に厄介なことに、電荷があるということは電界が発生するわ。それも、キャリアの動きを妨げる方向に。この、イオンによる電界が、ホールや電子自身の電荷による引力に勝った時に、再結合は止まって空乏層の拡張も止まるわよ。つまり、ホールや電子はこの空乏層を超えて移動することができなくなってしまうの。
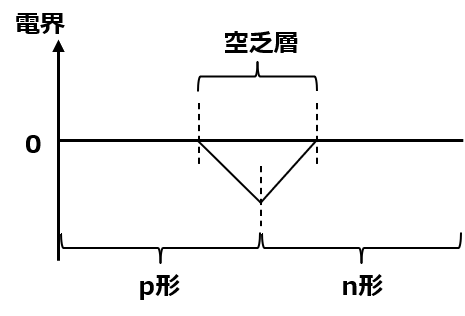
右に進もうとすると空乏層内が常に負の電界だから、プラスの電荷は右へは行けないわ。逆に、マイナスの電荷は空乏層を超えて左へは行けない。ここに外から電圧をかけて内部電界を打ち消して動かすのがダイオードで、電圧の向きが逆だと空乏層が広がってしまう。
で、太陽電池はどうするかというと、光を当てるの。だけどダイオードとは違って、空乏層の電界を打ち消すんじゃなくて、空乏層中のシリコン結晶から直接電子を取り出すの。
なんでそんなことができるかっていうと、光はエネルギーを持ってるから。原子核の束縛から電子を引き離すにはどうすれば良いんだったっけ? エネルギーを与えれば良かったよね。
空乏層とは言えど中身はシリコン。結合で電子殻がいい感じに埋まってるというだけであって、それ相応のエネルギーを与えてあげれば電子は取り出せるわよ。
しかもラッキーなことに、空乏層中には電界がある。つまり、電子を原子核から引き離すことさえできれば、その電界で勝手に移動してくれるのよ。
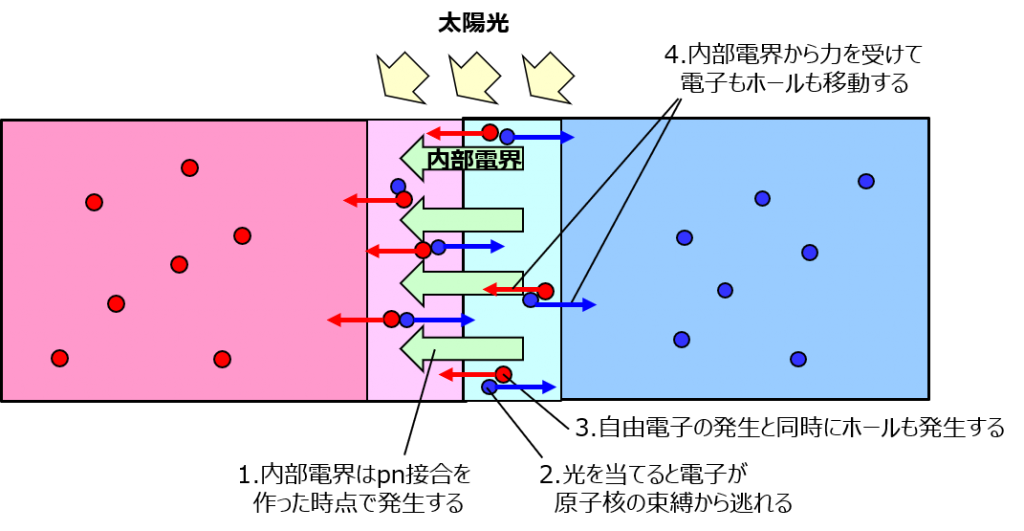
こうやって、p形にはホール、n形には電子が溜まっていくんだけど、空乏層部分のホールや電子を受けることで初期よりもその数が多くなるから、それぞれ帯電するわよ。
これでp形の左端とn形の右端の間に電圧が発生するから、外側を繋いであげればそこに電流が流れる。外の配線は金属だから電子しか移動しなくて、p形に入って来た電子がそこで待ち構えてるホールと再結合しちゃう。
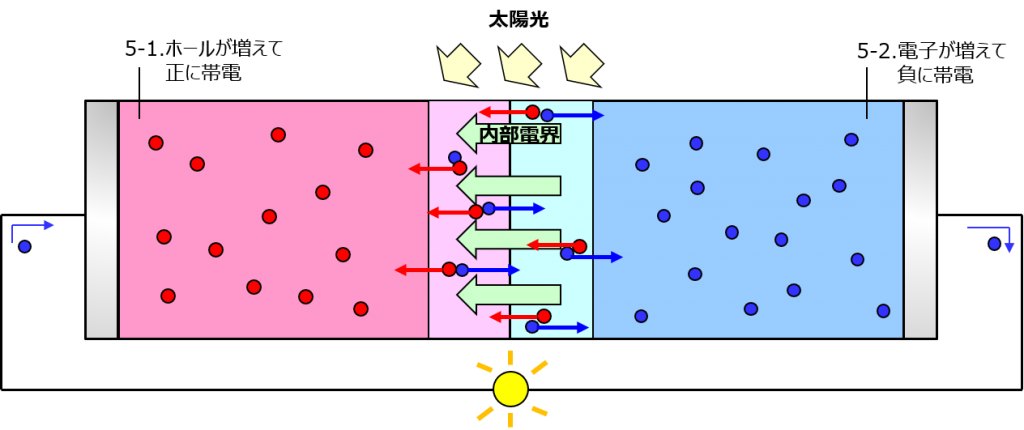
再結合は電子が抜け殻に戻るだけだから完全に消滅してしまう訳じゃなくて、光を当て続ければ発電は続くわよ。
電圧は、シリコンなら1.1Vぐらいになるわ。バンドギャップって言う、どれほどのエネルギーを与えれば電子を取り出せるかを示したパラメータによって決まるの。バンドギャップが大きいと強い光が必要になるけど、取り出せた時は高い電圧になるわよ。
電池の話はここまで。普段使ってるものがどんな感じで動いてるかっていうのはイメージできたかしら? 太陽電池はちょっと難しいんだけど、こんな感じになってるってことだけ知っといてね。脱化石燃料が叫ばれる世の中だから重要な技術になってるわよ。