さてこれから電池に向かって話が進んでいくわよ?
まず電池の原理だけど、前のページでやったイオン化を積極的に使ったものよ。アルミと酸素だと接触させるだけじゃ反応しないからエネルギーを与えてあげる必要があるんだけど、組み合わせ次第では室温のエネルギーでもイオン化するの。
実は、20℃そこらの温度でもエネルギーはあるわ。何なら氷にも、ドライアイスにも、液体窒素にもある。絶対零度(マイナス273.15℃)がエネルギーゼロのポイントで、そこより少しでも高ければ物質は熱エネルギーを持ってることになるの。その辺に転がってる石コロだろうと、空気だろうとね。
イオン化エネルギーの小さいカリウムとかだと室温でも酸素と反応しちゃうんだけど、もちろんそんなもので電池は作れない。室温で酸素と反応しない金属で、室温で動作する電池を作るにはどうすればいいか。そう、酸素を別のものに変えるしかない。
じゃあ、何を使う? アルミを室温でイオン化させるにはどうしたらいい? そう、硫酸に漬ければいい。硫酸に限らず、他から電子を奪う力が強いものを使えばイオン化させることができるわよ。
酸素とか硫酸のような、他から電子を奪う力を持っているものを酸化剤と呼ぶわ。逆に、相手に電子を与える力を持っているものを還元剤と呼ぶ。酸素とアルミの例で言えば、酸素が酸化剤でアルミが還元剤。電子のやり取りがある時は、必ず両方がセットになってるの。
つまり、世に聞く酸化とか還元とかの反応は、全部、電子のやり取りのことよ。酸素とくっつく時に大抵は電子を奪われるから、それを酸化と呼んでるってワケ。だから還元は、酸素が離れると同時に電子が戻って来てる。
もちろん、「酸素」という物質も酸化とか還元をするわよ。アルミとくっくけば電子がもらえるから自身は還元されてることになるし、酸化物イオン(O2-)から普通の酸素(O)に戻れば、電子を手放してるから酸化したことになる。
今回は電池に欠かせない電解液の話よ。電池では構成部品的な扱いで「電解液」って呼んでるけど、一応用語としての定義もあるわ。溶液、つまり何かが溶け込んでいる液体で、かつ電気を通すものを電解液と呼ぶわよ。
分かりにくいけど、ぶっちゃけ水に溶かすことが多いから「電気を通す水溶液を電解液と呼ぶ」でもいい。一応は、水以外のもの(アルコールとか油とか)でも何かを溶かした結果電気を通せば電解液。ただし水銀は電解液じゃないわ。あれは単体として液体の金属ってだけ。
もちろん硫酸は電解液。あとこの定義で言えば、海水とか泥水も電解液よ。実は、完全に純粋な水は電気を通さない。水道水とかが電気を通すのは、ミネラル、つまり金属が溶け込んでるからよ。
この、溶かす側のものを電解質と言うわよ。溶媒を水に絞って言えば、「水溶液が電気を通すものを電解質と呼ぶ」になるわね。だから金属は電解質よ。あと非金属では、食塩とかも電解質ね。
あれって、溶かしたやつが中でイオン化してるのよ。だから正確な定義を言うと、「水とかアルコールに溶かすとイオン化するものを電解質と呼ぶ」になるわね。余裕がある人はこっちで覚えてるとグッドよ。
定義の話をするとこうなるんだけど、電池の場合、強力な酸化剤に漬けりゃ金属がイオン化するんだから、その役割を果たすものを指して電解液と呼んでるってワケ。
電池というのは、イオン化した金属が手放した電子を外に取り出すと同時に、内部では電解液内で「電荷を持っている物質」の移動が起こっているわよ。まず電解液がどうやって電気を通してるのかってところを見ていきましょうか。わかりやすいやつで、食塩水から。
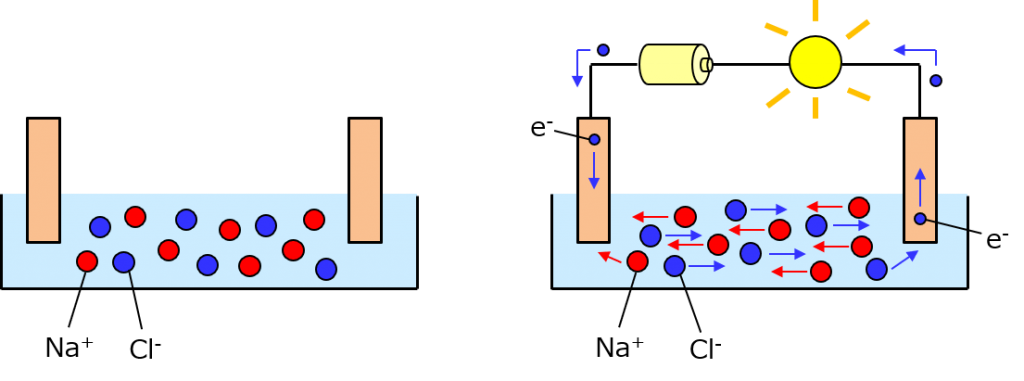
食塩はナトリウムと塩素がイオン結合したものなんだけど、水に溶かすとそれだけでイオン化するわよ。だから食塩水は、水の中でナトリウムイオンと塩化物イオンがウヨウヨしてる状態になってる。注意点として、上の図はあくまで、別途電池を用意して電流を流してるだけよ。食塩水というのは金属を溶かすほどの力は持ってないから電池にはならないわ。漬ける2本の金属が同じならどのみち電池にはならないけど。
で、右側の図の通り、2本の金属に電圧を掛けると導通するわよ。何故かと言うと、電圧を掛けることによって電解液内に電界が発生するから。
電解だとか電界だとか出てくるけど、ごっちゃにならないように気を付けてね。電界は、電位の傾きのことよ。この図で言うならば、電圧を金属板間の距離で割ったものに相当する。
電解液内には電界が発生している。そして、その電解液にはイオン、つまり「電荷を持っている物質」がある。だからイオンは、電界から力を受けて移動するの。電荷の移動こそが電流だったわよね。「クーロン毎秒」なんだから、電荷が移動すれば電流が流れてることになるのよ。もちろん、金属板と外の配線では電子が移動してるわよ。
ただ、これはいつまでも続く訳じゃない。図を見ての通り、イオンが寄って行っちゃうからね。
実は、金属板のところでは化学反応が起きてるわ。左側では電子がやって来てるから、それが水と反応して水素ができる。右側では塩化物イオンが電子を手放して塩素ができてる。式にすればこうよ。
2H2O + 2e- → 2OH- + H2
2Cl- → Cl2 + 2e-
この時、電子を受け取っている側(つまり左)を陰極、電子を手放している側(つまり右)を陽極と言うわ。OH-(水酸化物イオン)が余ってるけど、これはNa+とくっついてNaOH(水酸化ナトリウム)になるわよ。これ、やってることは食塩水の電気分解だからね。
じゃあ次、硫酸に金属を突っ込むと溶けるんだけど、その話に移るわよ。今まではアルミでやってきたけど、あれは電池に使う材料としては微妙だから、代表選手を変えて亜鉛。
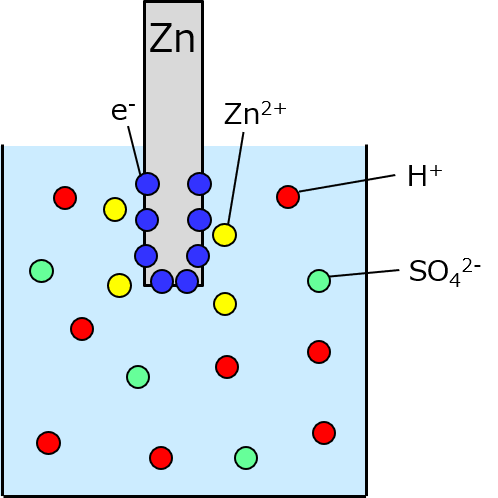
化学式はこうよ。
H2SO4 + Zn → 2H+ + SO42- + Zn2+ + 2e- → H2 + ZnSO4
まず、普通硫酸は水で薄めてあるから水溶液の状態で、その時点で水素イオン(2H+)と硫酸イオン(SO42-)に分かれてる。ここに亜鉛(Zn)を入れると、硫酸で溶けて亜鉛イオン(Zn2+)と電子(2e-)に分かれるわよ。そして 2H+ と2e- がくっついて水素(H2)に、SO42- とZn2+ がくっついて硫酸亜鉛(ZnSO4)になる。
なぜこうなるかと言えば、何度も言ってるけど、その方がエネルギーが低い状態でいられるから。
亜鉛原子というのは、電子を2個手放せば軌道の埋まり具合がちょうどよくなるの。そこに、既に液中でイオン化している硫酸イオン(SO42-)が待ち構えてるんだから、これはフォーリンラブするしかない。電子の受け取り手たる水素イオン(H+)もいるからね。文字通り自然の摂理よ。
もう一度言うわよ。硫酸に亜鉛を入れると化学反応が起きて、トータルでエネルギーが低い状態に移る。というかエネルギーが低い状態になりたいから化学反応が起こる。
じゃあ、減った分のエネルギーがはどこに行ってるのか? もちろん、外に捨ててる。大抵は熱になるわよ。化学反応と同時に熱くなるのはこのため。だけどやり方次第では、その捨てられたエネルギーを電気として取り出すことができる。それが電池よ。
最初の方で言った通り、酸化剤と還元剤の組み合わせが重要。式の真ん中の状態を見て欲しいんだけど、2H+ + SO42- + Zn2+ + 2e- だから、電子を受け取ることができる物質は2H+ と Zn2+ の2つある。
じゃあ何で、電子は水素とくっつく方を選んだと思う? そう、水素の方がイオン化傾向が低いから。イオン化傾向の高い亜鉛の方をイオンのままで残したということね。
イオン化傾向の高いものはイオン化エネルギー、つまりイオン化に必要なエネルギーが小さいから、イオン状態から元に戻る時に手放すエネルギーが小さい。
ホントに何度も言うようだけど、物質はできるだけ多くのエネルギーを捨てる方向に動くから、手放すエネルギーが大きい水素とくっつく方を選ぶの。
ということはだよ? 水素よりイオン化傾向の低いものは硫酸に溶けないってことになるわよね? 溶けたとしても、電子はまたそっちとくっつく方を選ぶ。金とか白金が硫酸に溶けないのはこのためよ。
電解液に漬けた時にイオン化するかどうかもイオン化傾向の序列で決まるなら、大小の比較だけじゃなくて数字も欲しいと思わない? 当然、科学者たちもそう思った。で、やっちゃった。それが標準電極電位と呼ばれるものよ。
定義の話をすると、標準電極電位というのは、標準状態で酸化還元反応をやった時の電極電位よ。標準状態というのは、実効濃度(活量とも呼ばれる)100%かつ平衡状態という意味で、平衡状態というのは時間経過で反応が終わって落ち着いた状態のことよ。
用語を説明しても分かりにくいままだと思うけど・・・水素とのペアで電池を作った時の起電力が、その物質の標準電極電位よ。
元素ごとのイオン化しやすさを比べるための相対的なものだからゼロの基準がどこかに必要で、その基準を水素にしたってこと。水素も強い酸化剤に突っ込めば H2 → 2H+ + 2e- でイオン化するけど、水素電極同士でペアを作っても同じ反応だから電位差はなくてゼロボルト。
このうち片方だけを亜鉛に変えて、両方とも実効濃度100%で反応させた時に得られる起電力が標準電極電位よ。もちろん、接続さえすれば電子が移動するから電池として使える。
亜鉛の標準電極電位はマイナス0.763 V。つまり水素電極の方が電位が高い(電池の端子としてはプラス)わよ。つまり、標準電極電位が低いものはイオン化傾向が高い。負の電荷を持つ電子を手放したがる方がマイナス端子になるってことね。
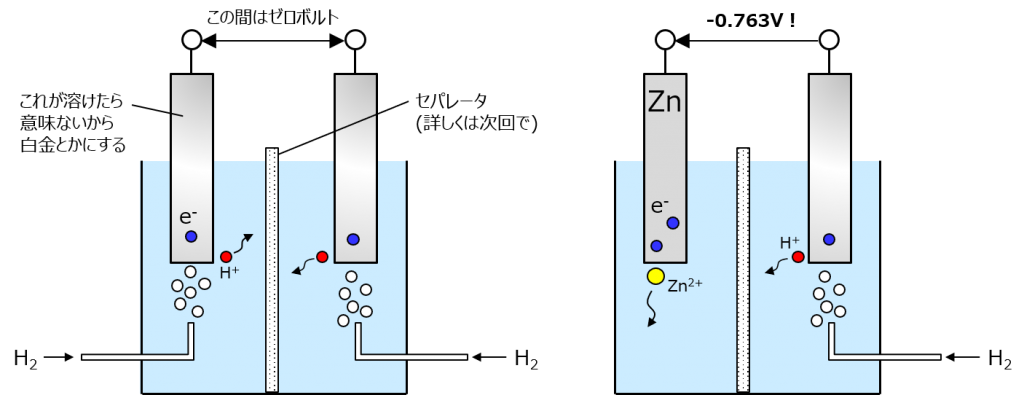
ちなみに、電解液にイオン化傾向の高いものを入れると色々と反応が起こるけど、例えば水素だけ(H2 → 2H+ + 2e-)とか亜鉛だけ(Zn → Zn2+ + 2e-)とかを抜き出したものを半反応と言うわよ。
さて標準電極電位というのは濃度が100%前提だったわね。でも実際は100%から落ちることも多い。その時の電位がどうなるかっていうのも既に定式化されてるわよ。
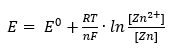
1つずついくわね。E0は、標準電極電位。実験的に求められるもので、亜鉛はマイナス0.763 V。
Rは、気体定数。8.31 J/(mol*K)。地球の重力加速度が9.81 m/s2に決まってるのと同じように、これは8.31に決まってる。
Tは、絶対温度。普段使ってるセルシウス温度に273.15を足したものよ。25℃だと298.15 Kね。
nは、半反応式中の電子の数。亜鉛だと2よ。
Fは、ファラデー定数。これも9.65 * 104 C/mol って決まってるわよ。この正体は、電子1個分の電荷(1.6*10-19)とアボガドロ定数(6.02*1023 mol-1;1モル当たりの粒子数のこと)の掛け算よ。
[Zn2+]は、平衡後(つまり反応が終わったあと)の亜鉛イオン濃度。電解液の種類や濃度によって亜鉛がどれくらい溶けるかも変わるから、最終的な溶液中の亜鉛イオン濃度のことよ。単位はmol/L。
[Zn]は、平衡後の亜鉛濃度。金属の濃度ってなんじゃいって話だけど、合金とかじゃない限りは100%よ。
見ての通り、上の式の大半は数字が決まってるものよ。それを反映させるとこうなるわ。
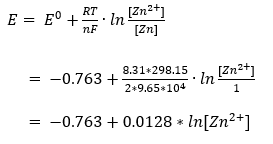
つまり、最終的に溶け込んだ亜鉛イオン濃度で決まるってことね。標準状態が1 mol/L と定めれてるから、mol / L のまま式に入れればオッケーよ。1の対数を取るとゼロだから、1 mol/L を入れるとちゃんと E0 になるわよ。
1 mol/L よりも濃度が落ちると対数の結果がマイナスになって、例えば10-10 mol/L だと 0.294 V 下がってトータルでマイナス1.057 V になるわ。
亜鉛にスポットを当てたけど、他の材料だとE0とnが変わるわよ。あと当然、濃度もその時の状況によって。
それから、酸化還元反応(つまり電子の移動を伴う反応)共通で一般化された式もあって、これ。ネルンストの式と呼ばれるものよ。
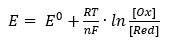
[Ox]と[Red]はそれぞれ、平衡後の酸化剤と還元剤の濃度よ。
Znのイオン化だと、電子を奪われることになるZnが還元剤で、Zn2+は軌道がちょうど埋まってるからそれ以上電子を与えるのは無理で、電気的中性を目指した電子の奪取はする可能性があるから酸化剤よ。
今回はここまでよ。イオン化傾向の差が平衡後の電位の差になるから、それを使ったのが電池ってことが分かったかしら? 次のページで具体的に、色んな電池について見ていくわよ。