まず初めに結論から書いておくわ。先に知っておいた方が読みやすいだろうから。

要はイオン化エネルギーも電子親和力も、大きいやつほど陽イオンになりにくくて、陰イオンになりやすい。んじゃ話に入っていくわよ。
電流が流れる時、そこには電荷の移動がある。そして普通の電気伝導は電子の移動によるものだって話をしたわね。電子はマイナスの電荷を持ってて原子核が持ってるプラスから引力を受けるから、その束縛から引き離してあげる必要があるってのは分かったかしら?
金属原子だと集まるだけでそれが達成できちゃうのも前回の話の通りなんだけど、電子を原子核の束縛から引き離すってトコにフォーカスを当ててくわよ? はい、またアルミ原子の図。
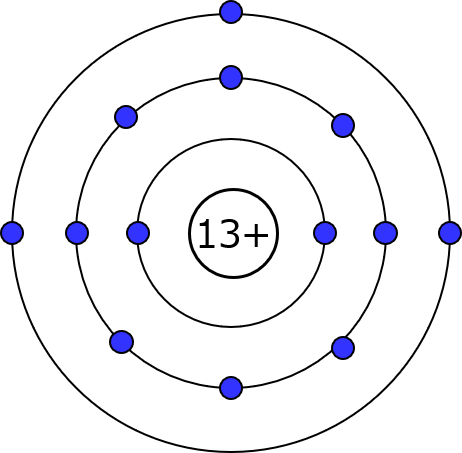
電子は全部で13個で、内側から2個、8個、3個の順で入ってる。原子核から受ける静電気力は遠い方が弱まるから、電気伝導用に取り出すのは一番外側、つまりM殻にある3個よ。
原子にとってもM殻に3個だけって状態は気持ち悪くて、アルミ原子ちゃんもこの3個を手放すか、あるいは電子を集めてせめてp軌道は埋めたいと思ってる。だけどそれには5個必要だから3個手放す方がラク。
そんな訳でアルミとか周期律表の左側にいる子たちは、電子を手放しやすい傾向がある。じゃあどうやって手放すかって言うと、他の物質と触れ合う時に狙う。テメェ電子受け取れやコラって感じで押し付けるの。
それを誰が受け取ってくれるかって言うと、周期律表の右側にいる子たち。この子たちは逆に電子があとちょっとあれば軌道が埋まる状態にあるから、テメェ電子よこせやコラって感じなワケ。
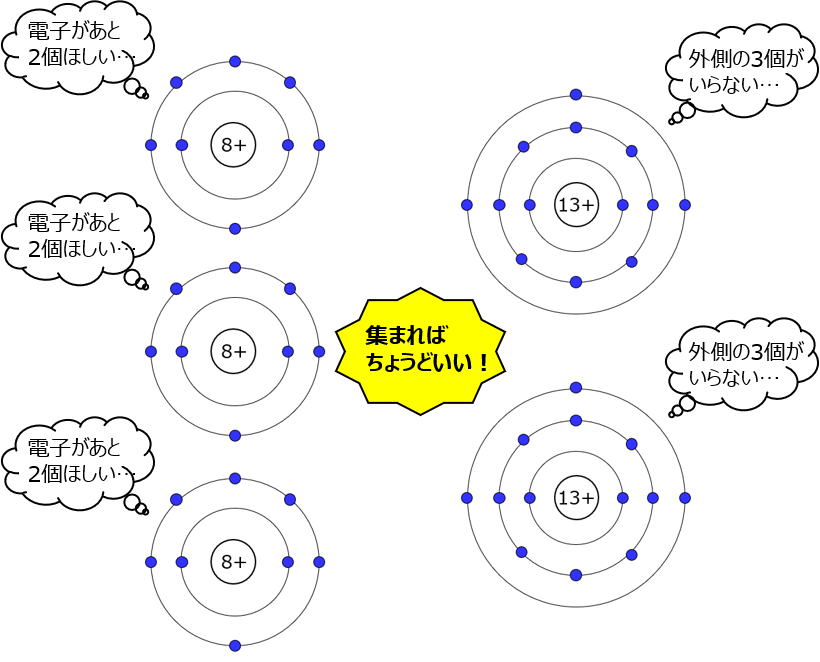
そんな2人が出会ったとき、見事にフォーリンラブして電子のやり取りが達成されるわよ。例えば酸素と出会うと、アルミは電子を3つ手放したくて酸素は電子が2つ欲しい。酸素はO2の状態で存在するから4つのアルミ原子と3つの酸素分子が集まって、
4Al + 3O2 → 2Al2O3
酸化アルミニウム(アルミナとも呼ぶ)が完成。10人でフォーリンラブしちゃったわね・・・。それはそれとして、アルミは電子を手放せたし、酸素は電子を受け取って軌道を埋めることができたからこれで安定する。
普通の原子、つまり陽子と電子の数が同じで中性の状態から手放したり受け取ったりするとバランスが崩れて電気を帯びるわよ。これをイオン化(電離とも呼ぶ)と言って、これによる結合をイオン結合と言うわよ。アルミとか酸素単体だけで式を作ると、こうなる。
Al → Al3+ + 3e–
O + 2e– → O2-
e– は電子で、Al3+ と O2- がイオンよ。それぞれ、電子を失うか得た数を右上に表示してる。電子を失うとイオンとしてはプラスの電荷を持つことになるから、アルミが「3+」よ。酸素は2個電子を得るから「2-」。んで、あとは数合わせで反応式は4Al + 3O2 になるの。O2 を図にするのが面倒だから3つのOと2つのAlにするけど、こんな感じ。
金属ってほっとくと錆びることがあるけど、あれが酸化ね。酸素は電子を欲しがってて、その酸素がそこら中をウヨウヨしてるから金属は錆びやすいのよ。
でもここまで聞いて「あれっ」て思った人、いるかもしれない。だってそこら辺にあるアルミは錆びてない。実はごく表面だけは錆びてるんだけど、内側までは浸食はされなくてそこで止まる。鉄とか銅はこの侵食ストップ機能が弱いから、その辺に放置してるだけで茶色とか黒になっていく。
話を戻すけど、アルミと酸素はただ出会うだけじゃくっつかないの。ごく表面が酸化してるとは言え、本当にごく表面だけだから、電気流れてるアルミに触ったら普通に感電するからね。
今更だけど、酸化アルミニウムは絶縁体だったわね。どうやって電気伝導のための電子を取り出すかって話をしてたのに絶縁体を作っちゃった。てへぺろ。
だけど、いかにして酸素とアルミをくっつけるかって話は電気伝導にも直結するから、このままいくわよ。出会ったアルミと酸素をくっつけて酸化アルミニウムになってもらうには、あるものが必要。そう、エネルギーよ。
結局のところ、酸素がそこにいるだけじゃあ、アルミ原子の最外殻電子を原子核(陽子があるためにプラス電荷)の引力から引き離すのは困難。そんな訳で、人工的にエネルギーを与えてあげればいい。じゃあ何のエネルギーを与えるかって言うと、一番手っ取り早いのが熱。文字通り、2人をおアツくしてあげるのよ。炙るなり何なりしてエネルギーを与えてあげれば、アルミ原子が電子を手放してそれを酸素が受け取れる。熱さえあれば、錆びにくいように作られた合金であるステンレスでさえ錆びるからね。
この、電子を手放させるために必要なエネルギーを、イオン化エネルギーと言うわ。これに相当するエネルギーを与えてあげれば、原子核の静電気力から解放して外に取り出すことができる。
イオン化エネルギーが大きいものはイオン化させるために大きなエネルギーが必要、つまりイオン化しにくいという訳だから、イオン化傾向が低いと言うわ。逆に、イオン化エネルギーが小さいと簡単にイオン化するから、イオン化傾向が高いということになるわよ。
どの元素がイオン化傾向が高いかは「イオン化エネルギー」で検索すればすぐよ。ちなみに一番はカリウム。室温のエネルギーでも一瞬で酸化するし、水のH2OからさえもOを奪って酸化するわ(Oを奪われた水は水素になる)。逆に、フッ素とかの周期律表の右側のはイオン化傾向が低くて(つまりイオン化エネルギーが大きい)、素の状態で電子軌道が埋まってる希ガスは特にイオン化しにくいわよ。
もう1つ、酸素について。実は、酸素は電子を受け取ると同時にエネルギーを放出する。厳密に言えば、できるだけエネルギーの小さな状態でいたいからエネルギーを捨てるために電子を受け取る。
この時、放出されるエネルギーを電子親和力と言うわ。この名前の意味するところは、電子親和力が大きいと電子を受け取りやすい傾向にあるってこと。たくさんのエネルギーを放出したがってる分だけ電子を欲してるのよ。
だけど、この電子親和力がマイナスになってるのもあるわ。希ガスがそうなのと、金属も一部がそう(マグネシウムとか)。電子親和力がマイナスってのがどういう意味かっていうと、電子を受け取ることにエネルギーが必要ってことで、つまりは電子を受け取ることはほとんどないってワケ。
むしろ金属も一部を除けば電子親和力がプラスなんだけど、何故かと言うと、原子核がプラスの電荷を持ってるから引力が働いてて、近付いてきた電子は取り込む傾向にあるためよ。だけど酸素の方が電子親和力が大きい(アルミ比で3倍)から一緒にいればそっちに行く。「親和力」の名の通り、電子は、これが大きいやつと一緒に居たい。
金属の話に戻るけど、ここで話をしたイオン化が、化学の力を使った発電装置、つまり電池の肝になるわよ。 電子の移動だけを考えるなら金属結合を押さえとけばオッケーなんだけど、電圧がなきゃ電子は移動できないからね。電圧はどうやってできるんだってのは知っとかなくっちゃ。