さて、ここから電気の具体的な話に入っていくわよ? 序章のつもりでやった単位の話も結構濃い内容になったけど、あれはあくまで序章。準備運動はここまでだ、ってやつね。
電荷の移動(クーロン毎秒)こそが電流で、電荷を動かすためのエネルギー的なもの(あくまで「的なもの」ね)が電圧だった。私たちの身の回りにある家電とかスマホも、電荷を持つ物質が移動することで成り立ってるんだけど、電荷を持つ物質というのは限られてる。電子と陽子、それにイオンと、あとはホールってやつよ。
電子は知っての通り、原子核の周りにあるやつ。1個当たりマイナス1.6×10-19クーロンの電荷を持ってるわ。大抵の電気伝導はこの電子が担ってるから、これからの話の主軸になるわよ。
陽子は、原子核の中にいるやつ。この子の数が原子番号になってるわね。電荷は電子と同じ大きさで極性が反対の、プラス1.6×10-19クーロン。この子がいるから、原子核はプラスに帯電してる。
イオンは、原子が本来は陽子と電子が同じ数あって中性になってるはずが、化学反応で電子を受け取るか手放すかして電荷を帯びたもの。何クーロンになるかはその時の状況によるけど、プラスなら陽イオン、マイナスなら陰イオンと呼ばれるわね。化学の話が多いこの章ではちょくちょく出てくるわ。
ホールというのは半導体で使う概念なんだけど、半導体に違う材料を混ぜると電子がどっか行っちゃうことがあって、たくさんの電子が並ぶ中で抜け殻になった場所を相対的にプラスの電荷を持つ粒子として扱ったものがホールよ。正孔とも呼ばれるわね。
その抜け殻に隣から電子が来ると今度は隣の方が抜け殻になるから、それはホールが移動したものとして扱うの。実体はないんだけど、便宜上プラスの1.6×10-19クーロンと、有効質量も与えられてる。ま、こういうのもあるってことだけ知ってて。
金属の電気伝導は電子が主役になるから、どんな原理で電子が移動してるのかを知るために原子構造のおさらいからするわよ。まずは非金属だけど、ヘリウム。
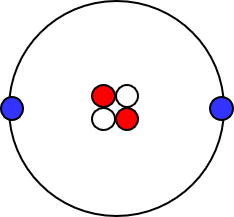
赤いのが陽子、白いのが中性子、青いのが電子よ。中心に陽子と中性子が2個ずつあって、この集まりが原子核。陽子の数が原子番号だから、ヘリウムは2番ね。
で、原子核の外側に電子がいる。実は原子核の周りを回ってる訳じゃないってことが判明してるんだけど、イメージしやすいから丸で電子軌道を表現することが多いわね。
電子軌道にも色々と階層があるんだけど、上の図はそのメインとなるもの、「電子殻」を描いたつもりよ。K殻とかL殻とかいうのを習った人もいると思うけど、それ。
K殻、L殻、M殻、N殻の順で続いていくんだけど、ヘリウムが持ってる2個の電子はK殻に収容されるわ。何故かと言うと、K殻に入った方がエネルギーが低い状態でいられるから。物質というのは、極力エネルギーが低い状態でいたがるの。高い所にあるものが自然に落ちていくのと同じように、物質はエネルギーが低くいられる場所を求めてそこに収まる。これ、重要だから覚えといてね。
さて、階層があると言った以上はサブの軌道があるんだけど、その話をするために原子番号が大きいものに移るわよ。代表は、私たちの呼吸にも必要な酸素。
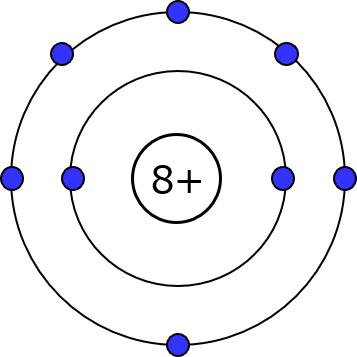
酸素の原子番号は8番。だから原子核には陽子が8個あって、中性子も描こうとするとキツキツになるからまとめて「8+」で表現するわ。
もちろん電子も8個。K殻には2個までしか電子が入れないって決まってるから、その外側にあるL殻に残りの6個は入るわよ。
それじゃあここで、サブの軌道の話に入るわね。L殻は、s軌道とp軌道の2つの軌道で構成されている。この、s軌道だとかp軌道のことを小軌道と言うわよ(英語ではマジでsubshellだけど)。
一番内側のK殻にはs軌道しかないわ。だからK殻は、このs軌道に電子が2個入っておしまいってことになるわね。
s軌道に電子が2個までしか入れないっていうのは、L殻もその後の殻も全部同じ。次のp軌道は容量が増えて、6個まで入るわよ。だからL殻はトータルで8個入る。酸素原子だとスペースが2個分余るけどね。
L殻にはsとpの2つの軌道があるけど、s軌道の方に優先して電子が入るわよ。何故かと言うと、p軌道よりもs軌道の方がエネルギーが低い状態でいられるから。フッカフカの椅子が真っ先に埋まって残りの人が木の椅子になるようなものよ。人には遠慮という要素があるけど、物理現象でそれはないからね。とにかく低いエネルギー状態を彼らは好む。
そんな訳だから酸素が持ってる8個の電子は、K殻(s軌道しかない)に2個、L殻のs軌道に2個、L殻のp軌道に4個っていう振り分けになるわよ。
ちなみに、K殻のs軌道を「1s軌道」、L殻のs軌道を「2s軌道」、L殻のp軌道を「2p軌道」って言うこともあるわ。
この、K殻とかL殻を表す「1」とか「2」を、主量子数と呼ぶ。それで更に、s軌道には「0」、p軌道には「1」の数字が当てがわれてて、これを方位量子数と呼ぶわよ。
更に更に、磁気量子数とスピン磁気量子数なんてのもあったりして、どこに優先して電子が入るかは細かくルール化されてるんだけど、その辺はコラムで。
さてせっかくだから、原子番号20番のカルシウムまでをざっと表にしてみたわよ。数字が収容されてる電子の数ね。黄色く塗ってあるのは周期律表の一番右の元素、つまり希ガスよ。

いやd軌道に入らんのかいって感じだけど、M殻のd軌道よりもN殻のs軌道の方が低いエネルギー状態でいられるから先にそっちに入るのよ。21番のやつ(スカンジウム)でようやくM殻のd軌道に1個。
希ガスのアルゴンはM殻に空きがあるけど、p軌道が埋まってればそれなりに安定するから希ガスなのよ。
なんでこんな話をしてるかって言うと、軌道の収容数ピッタリに電子が埋まってるかがこの先重要だからよ。
希ガスは安定するって言ったわよね。これは、軌道がちょうど埋まってるからよ。と言うよりはむしろ、軌道がちょうど埋まってる元素は安定しやすいことを人類は発見した、と言った方が正しいわね。
さて何度も言うけど、物質はエネルギーが低い状態を好む。安定しやすいということは、元からエネルギーが低い状態だから変化のしようがないことを意味してるのよ。つまり、軌道がちょうど埋まってる状態というのはエネルギーが低い状態ということよ。
だから軌道が中途半端に埋まってるものは、電子が近付いて来たら取り込んだり、もうちょっとで軌道が埋まる元素が近付いて来たら電子を渡したりする。
いい? もう一度言うわ。物質は、エネルギーが低い状態を好む。電子軌道がちょうど埋まってる状態は、比較的エネルギーが低い。そうなるために、物質は電子を渡したり受け取ったりすることがある。
電子は、電荷を持っている。電荷を持っている粒子の、受け渡しが行われる。そして、電荷の移動こそが電流だった。つまりは・・・さあ、電気の始まりだ。
実際は原子間で電子をやり取りするだけじゃ電流として観測できないんだけど、電子が元いた原子からずっと遠くまで移動させることができれば、それが電流よ。アンペアはクーロン毎秒と一緒だからね。
電子を元いた原子から離すってことは原子核から引き離すってことだけど、そもそも何で原子核の周りにいるかって言うと、電子がマイナスの電荷を持ってて原子核は陽子がいることでプラスの電荷を持つことになるから。違う極性同士だと引力が働くから、言わば電子は原子核からの束縛を受けてることになるのよ。
引力があるのに何で完全にくっつかないんだって話は結構ややこしんだけど、色んな制約があって電子は原子核と完全なゼロ距離には存在できないの。電子が原子中のどこに存在できるかは限られてて、彼らはその制約の中で動いてるの。その、電子が存在できる場所こそが電子殻で、その中で「この位置にいる確率が何%」みたいな感じで確率分布が計算されてる。
これまで描いてきた図、原子核がそれなりの大きさになってるけど、実際は原子全体の10万分の1程度の半径しかないわ。つまり原子の容積の大半は電子がウヨウヨしてる場所ってことね。
ちなみに原子の直径は0.1ナノメートル(千万分の1ミリ)で、原子核は直径0.000001ナノメートル。だから私たちの目に見えてるものは何億とか何十億じゃ足りないほどの原子が集まってるってワケ。
原子番号が増えていくと外側の殻に電子が入っていくけど、実は原子としてのサイズはそんなに変わらなくて、大きいのでも0.5ナノちょっと。何故かと言えば、電子と陽子が増えるから引力も強くなって軌道ごと内側に寄って来るからよ。
いよいよ電気の話に入るけど、電子は原子核が持つプラスの電荷の引力で束縛を受けてるから、そこから引き離してあげることで電気として取り出せる。
実は、っていう程のものでもないんだけど、それができるのが金属で、酸素とかの非金属は電子を引き離すのが簡単じゃない。というか余程の状況(かなりの高温とか)じゃなきゃなんない。
電子軌道がキレイに埋まってる状態が安定するって話をしたけど、酸素原子は電子をあと2個取り込むか元から持ってる6個を追い出すかで、当然2個取り込む方が楽なのよ。だからその逆をいく「電子を追い出す」ってのはなんない。「電子を追い出す」ができないということは電圧を掛けても電子が移動しないことを意味するから、酸素が絶縁体なのはこのためよ。
周期律表の右側に金属がほとんどないのもこのためで、あとちょっと電子があれば軌道が埋まる状態にあるから、彼らは基本的に電子を手放さない。
逆を言えば、周期律表の左側には電子を手放したがるやつが多い。というか水素以外は金属。電子を1個2個手放すだけで軌道をスッカラカンにできるからね。という訳で、金属原子の電子配置図がこれよ。代表として、比較的若い番号で導電材料してポピュラーなアルミ。
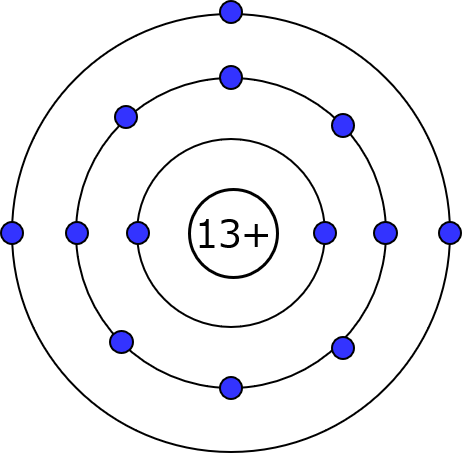
原子番号は13番。L殻も完全に埋まり、M殻に3つ入ってる。M殻のp軌道を埋めるにはあと5個いるから、3つ追い出した方が手っ取り早いわね。どうやって追い出すかなんだけど、実は、アルミ原子が集まって塊になった時点で、その準備はほぼ整ってる。イメージとしてはこうよ。
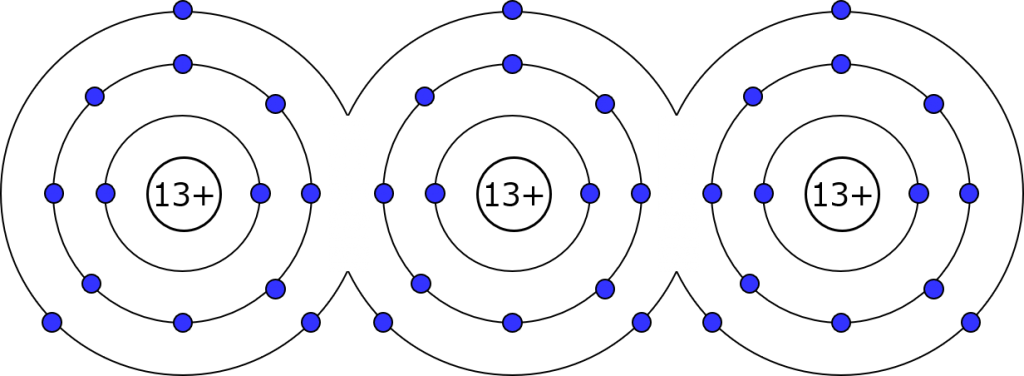
M殻の輪っかがくっついちゃったわね。だけど実際の軌道がこんな形をしてる訳じゃないから、あくまでイメージだと思って。軌道がくっついて共有してるっていうイメージね。
これで電圧を掛ければ、電子は元いた原子を離れて移動していくわよ。原子相互間での荷電粒子の移動は、電気伝導を意味するわ。
実際、アルミの棒が何メートルになろうとも電子はずっと移動していける。この時、掛けた電圧(正確には電界)に対してどれくらい電子のスピードが出るかという観点で決まるのが導電率と抵抗率よ。(詳しくは導電率のページで)
絵は二次元でしか描けなかったけど、リアルでも3次元でこうなってるわよ。だから正確なことを言うと、電子は外側だけじゃなくて内側も通って行ける。四方八方をアルミ原子で囲まれていようとも、アルミの塊全体で皆のM殻にいる電子を共有してるから、表面だけじゃなくて内部も通って行くわよ。(もちろん電圧を掛けたらの話だけど)
これが金属の特徴的なところで、とにかく彼らは電子を手放したがるから、隙あらば手放す準備をするし、電圧が掛かれば電子はサヨナラ。まあ、隣の原子が手放した電子がすぐ来るし、回路を組めば1周回って戻って来るんだけどね。
原子同士がくっつくのを結合(正確には化学結合)って言うんだけど、この、塊全体で電子を共有するような結合を金属結合というわ。文字通り、金属だけに見られるものよ。そして、こうやって元いた原子から離れて移動できるようなったものが自由電子よ。
自由電子のことを単に「電子」とだけ言うことも多くて、特に区別がいらない時はこの講座でもそうするわ。金属が電子を手放したがるのと同じように、人間だって言葉を省略したがる。
こうやって、電気伝導の担い手となったもの、つまり電界があれば移動できるものをキャリアって言うわよ。英語で言うところのcarry(運ぶ)にファイターとかチャレンジャーとかの ”er” を付けたものよ。電荷を運ぶ役割をするから、キャリア。
キャリアに該当するのは、原子核の束縛から逃れた電子(自由電子)と、イオンとホールね。陽子は取り出せないからキャリアになれないのと、電子も、原子核から引き離すまではキャリアとは呼べない。
最初の方でもチラッと出たけど、原子が電子を受け取るか手放して帯電したものがイオンよ。金属だと基本は手放すから陽イオンになる。だから金属結合というのは、金属原子が陽イオンと自由電子に分かれる結合ということにもなるわね。
改めて図を描くと、こう。最外殻(一番外側の電子殻、アルミで言えばL殻)の電子しか取り出せないから、内側の殻と原子核をひっくるめて「Al3+」っていう存在にするわね。これが他でもない、アルミニウムイオンのことよ。Al原子から電子が3つ出てったもの。そして電子はアルミの塊の中を、(電界があればだけど)移動して回れる。
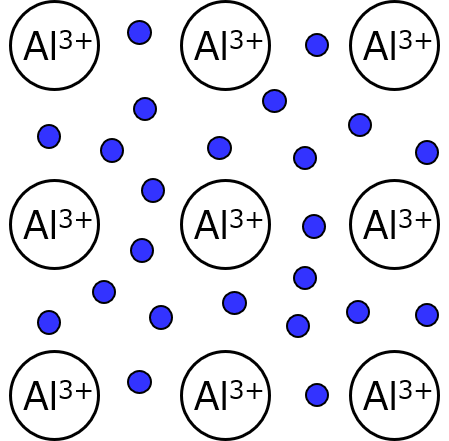
ただあくまで、これはイメージだと思っておいて。超拡大の顕微鏡があったところで、アルミがこうなってるのを観測できる訳じゃないの。でも事実としてアルミに電圧かけたら電子が移動するから、現象を基に学者たちがモデルを考えて、理論を構築していくのよ。だからこの図も考え方の1つに過ぎなくて、もちろんキミが新たな理論を打ち立てることもできる。現役の学者たちに認めてもらう必要はあるけど。
ところでさっきから、「電圧を掛ければ電子が移動する」って言ってるけど、その電圧はどこから持ってくるんだよって話になるわよね。答えを言うと、電池か発電機。
電池は化学、発電機は磁石の力を使ったものなんだけど、人類の歴史で言えば電池が先で、磁石の話は難しくてまだできないから、電圧の発生源たる電池についてこれから話を進めていくわよ。鍵を握るのは、イオン。わざとらしくイオンの話を出したのも、このためよ。
電気回路の話が欲しい人、ごめんね、待ってて。回路図では当たり前のように電源が出てくるけど、その電源の正体も知ってた方が圧倒的に良い。ブラックボックスはできる限りなくしてから臨まなきゃね。
~column~
量子数の話をした時に、K殻とかL殻に対応する主量子数と、s軌道とかp軌道とかに対応する方位量子数の他に、磁気量子数とスピン磁気量子数があるって話をしたわね。文字を並べるよりも先に表を出すわよ。ばーん。面倒だから10番のネオンまでしかないけど。
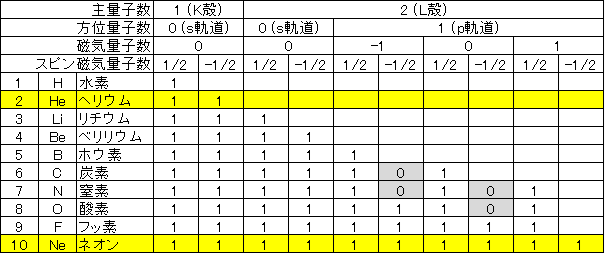
見ての通り、電子の収容場所は細かく分けると全部1個ずつ入れないことになるわよ。これをパウリの排他律と言うわ。
s軌道が2個までなのに対してp軌道が6個入るのは、p軌道が更に3つの軌道に分かれてるからよ。方位量子数をℓ、磁気量数をmとすると、mが取る範囲は、-ℓ、-(ℓ-1)、・・・、-1、0、1、・・・ℓ-1、ℓ になるわ。p軌道は ℓ が1だから-1、0、1の3つってワケ。表にはないけどd軌道なら2と-2が追加されて5つになる。
あと表を見て気になってると思うけど、p軌道の電子の埋まり方は、それぞれの軌道の「1/2」のスピンが先に入って、3つとも「1/2」が埋まった状態でようやく酸素原子で「-1/2」に電子が入るようになる。
何故かと言うと、電子は負の電荷を持ってるから複数あると反発し合って、できるだけ離れようとするからよ。別の軌道が空いてればそっちに行っちゃう。
で、今更だけど「1/2」と「-1/2」は電子のスピンの向きを示すものよ。実は電子というのは地球と同じように自転してて、その回転方向が2通り(それもちょうど真逆の関係)だから、「1/2」と「-1/2」で表現してるの。
こういう風にして、一定の規則に沿って電子はそれぞれの軌道に配置されていくの。実は磁石はこれが基になってるものだから、頭に入れておくと理解が早くなるかもね。